SÍNDROME DE OVARIO POLIQUÍSTICO
Los primeros en describir el mencionado síndrome fueron Stein y Leventhal en el año 1935 con un estudio de siete mujeres con amenorrea, hirsutismo y ovarios de gran tamaño asociado a infertilidad.
DEFINICIÓN
EL síndrome de ovario poliquístico (SOP) es un trastorno endocrino-metabólico que afecta al 4-10% de las mujeres en edad reproductiva, se caracteriza por alteraciones hormonales y se explica como un hiperandrogenismo femenino funcional, en el cual el ovario secreta excesivamente andrógenos.
Las pacientes deben llenar dos de los tres criterios siguientes:
1. Hiperandrogenismo: hirsurtismo, hiperandrogenemia o ambos.2. Disfunción ovárica: oligooculación-anovulación, ovarios poliquísticos o ambos.3. Ovários poliquísticos a la ecográfia (puede variar en la paciente).
Sin embargo se deben descartar otras enfermedades que también provocan oligoovulación, hiperandrogenismo o ambos, como hiperplasia suprarrenal congénita, tumores productores de andrógenos e hiperprolactinemia.
EPIDEMIOLOGÍA
Es importante destacar que la prevalencia no varía significativamente en los distintos países de Europa, estimándose 6,8% en Grecia, 8% en el Reino Unido y en España 6,5%.
Resultados similares se han observado en América del Norte. En Estados Unidos se han informado cifras de hasta el 6%, y América Latina se convierte en la región del mundo más afectada con un índice alrededor del 5-15% en la edad reproductiva. En Chile, la prevalencia es de 12%.
ETIOLOGÍA
La causa del SOP se desconoce. No obstante, se sospecha de una base genética que es tanto multifactorial como poligénica, puesto que existe agregación familiar demostrada del síndrome.
Entre los genes que se postulan para esclarecer la etiología genética del síndrome, se encuentran aquellos que codifican para enzimas que participan en la síntesis de andrógenos, 2 de estos genes son los que codifican para la enzima 17 α hidroxilasa o citocromo P45017 α y para el citocromo P450 scc, denominados respectivamente CYP17 y CYP11α.19 Existen publicaciones que avalan la aumentada expresión de P45017 α y P450scc en las células de la teca de ovarios de mujeres con SOP.
Una mutación activando el gen receptor de LH puede ser la causa del hiperandrogenismo en el SOP, particularmente en aquellos sujetos con concentraciones normales de LH en suero y elevados niveles de andrógenos, sin embargo, no se encontraron evidencias. Recientemente se publicó un estudio realizado en adolescentes con SOP, en el cual se analizó el gen que codifica para el receptor de la FSH, y se encontró que este gen contiene 2 polimorfismos de nucleótido único en el exón 10, que ocasionan un cambio de 2 aminoácidos en las posiciones A307T y N680S, situados en el dominio extracelular de receptor para la FSH, lo que afecta la señal de transducción
Estudios moleculares de la región del gen que codifica para el receptor de insulina en mujeres con SOP, han demostrado tener gran número de polimorfismos silentes. El gen que codifica para el receptor de insulina contiene 22 exones, y se localiza en el 19p 13.3-p13.2.
FISIOPATOLOGÍA
GONADOTROPINAS Y ANDROGENOS
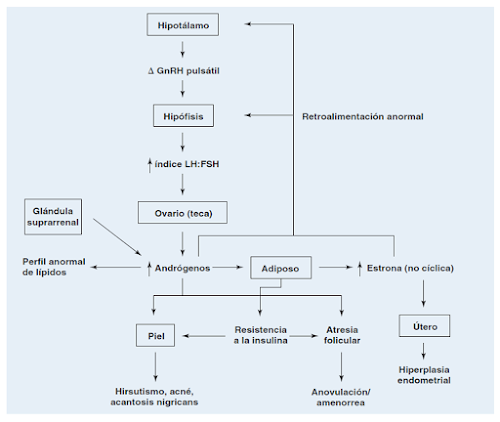
La anovulación en las mujeres con SOP se caracteriza por la secreción inapropiada de gonadotropinas. Específicamente, las alteraciones en las pulsaciones de hormona liberadora de gonadotropinas GnRH) provocan mayor producción de hormona luteinizante (LH) que de hormona folículo estimulante (FSH).La concentración sérica de LH se eleva, lo que se observa en la clínica en 50% de las pacientes.
Las alteraciones en la liberación pulsatil de la hormona liberadora de gonadotropinas (GnRH), libera pulsaciones rápidas las cuales provocan un aumento relativo de HL, que de cierta forma actúa contra la biosíntesis y la secreción de FSH.
La FSH a niveles normales se encarga de convertir los androgenos en estrogenos, sin embargo como hay una disminución de esta a nivel hipofisario, los androgenos se acumulan en el organismo y de esta forma se contribuye a la luteinización prematura del folículo, luteinizando las células de la granulosa en una fase folicular media, generando una detención en la maduración folicular, dificultando la aparición de un foliculo dominate manifestandose en la paciente como una oligoovulación-anovulación.
La HL estimula la producción ovárica de androgenos en las células de la teca, mientras que la disminución de la FSH impide el estimulo de la aromatasa dentro de las células de la granulosa, reduciendo así la biotransformación de androgenos al estradiol.
Posteriormente la estimulación de androgenos en las células de la granulosa, causa que estos sufran atresia y a la vez causa una mayor concentración de androgenos circulantes.
La concentración elevada de andrógenos circulantes contribuye a las anomalías en el perfil de lípidos de las pacientes y a la aparición de hirsutismo y acné. Los andrógenos elevados también pueden provenir de la glándula suprarrenal.
Los andrógenos séricos elevados (principalmente androstenediona) se biotransforman en la periferia en estrógenos (principalmente estrona). Puesto que la biotransformación se produce principalmente en las células del estroma del tejido adiposo, en las pacientes obesas con SOP la producción de estrógenos aumenta. Esta biotransformación genera la retroalimentación crónica en el hipotálamo y la hipófisis, a diferencia de las fluctuaciones normales en la retroalimentación que se observan en presencia de un folículo en vías de maduración y de una concentración rápidamente cambiante de
estradiol.
A nivel del endometrio, el recambio constante de su epitelio causado por la estimulacion androgenica nos puede causar una displacía endometrial, que termine en un CA endometrial.
GLOBULINA TRANSPORTADORA DE HORMONAS SEXUALES
En las mujeres con SOP, la concentración de globulina transportadora de hormonas sexuales (SHBG) es reducida. Esta glucoproteína producida en el hígado fija a la mayor parte de los esteroides sexuales. Sólo 1% de estos esteroides no se encuentra unido y por lo tanto está libre y biodisponible. La biosíntesis de SHBG se suprime con insulina, andrógenos, corticoides, progestágenos y somatostatina. Puesto que la producción de SHBG disminuye, menos andrógenos circulan unidos a la proteína y una mayor cantidad se encuentra disponible para unirse con los receptores de los órganos terminales. Es por esta razón que en algunas mujeres con SOP la testosterona total es normal, pero padecen hiperandrogenismo por la testosterona libre elevada.
DISTRIBUCIÓN DE GRASA Y RESISTENCIA A LA INSULINA
La obesidad se presenta en las pacientes con SOP en un porcentaje variable, que según los diferentes auto-res oscila entre el 31 y el 60%. Se sabe que el tejido adiposo subcutáneo puede tener distintas formas de distribución: andrógena, infantil y ginecoide. Las 2 primeras se encuentran en pacientes con SOP. El patrón androgénicode distribución del tejido adiposo subcutáneo se caracteriza por un aumento de este tejido en el muslo y en el tronco, y se presenta con frecuencia en las pacientes con SOP que son obesas. El patrón infantil, en cambio, se observa con mayor frecuencia en las pacientes con SOP que son delgadas, y se caracteriza por una disminución del tejido adiposo subcutáneo en el tronco y especialmente en los muslos y un aumento de este a nivel de las vísceras abdominales.
Es conocido que tanto el SOP como la obesidad se asocian con la RI, que se define como una condición en la que una concentración normal de insulina produce un efecto biológico atenuado, por lo tanto, disminuye la capacidad de esta hormona para ejercer sus acciones biológicas en los tejidos típicos, como el músculo esquelético, el hígado o el tejido adiposo.
La resistencia a la insulina se asocia con aumento de la frecuencia de riesgos ulteriores como diabetes mellitus tipo 2, hipertensión, dislipidemia y enfermedades cardiovasculares.
SIGNOS Y SÍNTOMAS
Las molestias de las mujeres con PCOS provienen de diversos efectos endocrinos y comprenden irregularidades menstruales, esterilidad, manifestaciones del exceso de andrógenos y otras disfunciones endocrinas. Los síntomas suelen manifestarse dentro de los primeros años después de la pubertad.
DISFUNCIÓN MENSTRUAL
La disfunción menstrual en las mujeres con SOP varía desde amenorrea u oligomenorrea hasta menometrorragia episódica con anemia. En muchas mujeres con SOP, la amenorrea y la oligomenorrea son resultado de la anovulación. En este escenario, la falta de ovulación impide la producción de progesterona y por lo
tanto la supresión de la misma que ocasiona las menstruaciones. De manera alterna, la amenorrea puede ser el resultado de las concentraciones aumentadas de andrógenos en mujeres con SOP. Específicamente, los andrógenos contrarrestan a los estrógenos para generar un endometrio atrófico. Por lo tanto, no es raro observar amenorrea y una banda endometrial delgada en las pacientes con SOP y andrógenos elevados. En cambio, con la amenorrea las mujeres con SOP pueden tener sangrados profusos e impredecibles. En estas pacientes no se produce progesterona debido a la anovulación y da como resultado la exposición crónica a estrógenos. Esto ocasiona la estimulación mitógena constante del endometrio. La inestabilidad del endometrio engrosado produce un patrón de sangrado impredecible. De forma característica, la oligomenorrea (menos de ocho periodos menstruales en un año) o amenorrea (ausencia de la menstruación durante tres meses consecutivos o más) de la SOP empieza con la menarquia. Alrededor de 50% de todas las niñas posmenárquicas manifiesta menstruaciones irregulares hasta dos años después por inmadurez del eje hipotálamo-hipófisis-ovario.
Sin embargo, en las niñas con PCOS los ciclos menstruales ovulatorios no comienzan a la mitad de la adolescencia y con frecuencia siguen siendo irregulares.
HIPERANDROGENISMO
Esta condición se manifiesta por hirsutismo, acné, alopecia androgénica o estas dos últimas. Por el contrario, los signos de virilización como aumento de la masa muscular, disminución del tamaño mamario, voz grave y clitoromegalia no son típicos del SOP. La virilización refl eja elevación de los andrógenos y obliga a realizar una investigación en busca de un tumor productor de andrógenos en el ovario o la glándula suprarrenal.
- HIRSURTISMO
El hirsutismo se define como vello grueso, oscuro y terminal distribuido con un patrón masculino. El hirsutismo se debe distinguir de la hipertricosis.
El síndrome de poliquistosis ovárica corresponde a 70 a 80% de los casos de hirsutismo y es la segunda causa más frecuente es el hirsutismo idiopático.
Las mujeres con SOP por lo general revelan que el hirsutismo inició al final de la adolescencia o al principio de la tercera década de la vida. También existe una serie de fármacos que pueden provocar hirsutismo, por lo que se debe investigar si las pacientes los han utilizado.
FARMACOS QUE PUEDEN CAUSAR HIRSURTISMO
- Esteroides anabolicos
- Danazol
- Metoclopramida
- Metildopa
- Fenotiazinas
- Progestágenos
- Reserpina
- Testosterona
- ACNÉ
Aparece frecuentemente en las adolescentes y generalmente para los 15 años de edad el 50% de ellas lo presentará. Su permanencia de los 20 años en adelante debe considerarse sospechosa. Es imperativo interrogar acerca de irregularidades
menstruales, hirsutismo o cualquier otro dato de hiperandrogenismo. Estas pacientes pudieran presentar niveles anormales en los andrógenos séricos, pero los niveles de éstos no tienen correlación con la severidad del acné. En estudios realizados en mujeres con acné se ha encontrado datos de SOP hasta en el 45% de los casos.
- ALOPECIA
La alopecia androgénica femenina es menos frecuente en las mujeres con SOP. La pérdida de pelo avanza lentamente y se caracteriza por adelgazamiento difuso en la coronilla con preservación de la línea de pelo frontal o por recesión bitemporal. En su patogenia participa un exceso de actividad de la 5α-reductasa en el folículo piloso provocando una elevación en la concentración de DHT. Además, aumenta la expresión de los receptores de andrógenos.
Por otro lado, la alopecia en ocasiones refleja otra enfermedad grave. Es por tal razón, que debe valorarse a las pacientes para excluir la posibilidad de enfermedad tiroidea, anemia o alguna otra enfermedad crónica.
- ACANTHOSIS NIGRICANS
Este fenómeno cutáneo se caracteriza por la presencia de placas gruesas, aterciopeladas y de color café grisáceo en los pliegues de flexión como la porción posterior del cuello, axilas, surco submamario, cintura y región inguinal. Se considera un marcador cutáneo de resistencia a la insulina y se observa en aquellas mujeres con o sin SOP. La resistencia a la insulina provoca hiperinsulinemia, que aparentemente estimula el crecimiento de los queratinocitos y fibroblastos dérmicos, generando los cambios cutáneos característicos. La acantosis nigricans es más frecuente en las mujeres obesas con SOP (incidencia de 50%) que en las que tienen SOP con peso normal (5 a 10%).
DISLIPIDEMIA
El perfil aterógeno clásico de las lipoproteínas que se observa en el SOP se caracteriza por elevación de las lipoproteínas de baja densidad (LDL), triglicéridos y relación de colesterol total:lipoproteínas de alta densidad (HDL), así como HDL reducida. Independientemente de la concentración total de colesterol, estos cambios aumentan el riesgo de cardiopatía en las mujeres con SOP. La prevalencia de dislipidemia en el SOP es de casi 70%.
En comparación con las testigos de edad similar, las mujeres con SOP tienen mayor tendencia a padecer obesidad, lo que se refleja por un mayor IMC e índice cintura:cadera. Este índice refleja una obesidad de patrón androide o central, que en sí misma constituye un factor de riesgo independiente de cardiopatía. Este patrón de circunferencia de cintura aumentada y de engrosamiento de los pliegues subescapulares también son predictivos de resistencia a la insulina.
Como ya se mencionó, se cree que la resistencia a la insulina contribuye de forma considerable a la patogenia del SOP y a menudo se exacerba por obesidad. Las mujeres afectadas muestran un índice alto de cintura:cadera, adipocitos aumentados de tamaño, concentraciones de adiponectina disminuidas y menor actividad de lipoproteína lipasa.
RESISTENCIA A LA INSULINA
Aunque no se ha identificado con claridad, desde hace tiempo se sabe que existe cierta asociación entre la resistencia a la insulina, el hiperandrogenismo y el SOP. Es difícil definir la incidencia exacta de la resistencia a la insulina en mujeres con SOP puesto que no existe un solo método sencillo para determinar la sensibilidad
a la insulina en el consultorio. Se sabe que la obesidad exacerba la resistencia a la insulina y en un estudio clásico se demostró que las mujeres tanto delgadas como obesas con SOP tienen una mayor frecuencia de resistencia a la insulina y diabetes mellitus tipo 2 (DM) que las testigos de peso similar sin SOP.
Las mujeres con PCOS tienen mayor riesgo de padecer intolerancia a la glucosa (IGT) y diabetes mellitus tipo 2. Con base en la prueba de tolerancia a la glucosa oral de mujeres obesas con SOP, la prevalencia de IGT y diabetes mellitus es de casi 30 y 7%, respectivamente. Las mujeres con SOP presentan mayor posibilidad de desarrollar DM, aun después de ajustar para el índice de masa corporal (BMI). Específicamente, se ha observado disfunción de las células β independiente de la obesidad en las pacientes con SOP.
APNEA OBSTRUCTIVA DEL SUEÑO
La apnea obstructiva del sueño es más frecuente en las mujeres con SOP y está vinculada a la obesidad central y la resistencia a la insulina. Sin embargo, en algunas investigaciones se ha observado que el riesgo de padecer apnea del
sueño es entre 30 y 40 veces mayor en las mujeres con SOP que en las testigos de peso similar. Esta evidencia indica que existe una relación entre la apnea obstructiva del sueño y las anomalías metabólicas y hormonales asociadas con el SOP. Puede haber dos subtipos de PCOS, es decir, PCOS con o sin apnea obstructiva del sueño.
SÍNDROME METABÓLICO Y ENFERMEDADES CARDIOVASCULARES
Este síndrome se caracteriza por la resistencia a la insulina, obesidad, dislipidemia aterógena e hipertensión. El síndrome metabólico se asocia con un aumento en el riesgo de enfermedad cardiovascular (ECV) y diabetes mellitus tipo 2. La prevalencia del síndrome metabólico en mujeres con SOP es de aproximadamente 45%, contra 4% en testigos de edad similar. El SOP comparte una serie de características endocrinas con el síndrome metabólico, aunque no existe evidencia definitiva demostrando una mayor frecuencia de ECV en las mujeres con SOP.
Sin embargo, en un pequeño número de mujeres con SOP, pronosticaron un riesgo relativo de infarto del miocardio de 7.4%.
Además de los componentes del síndrome metabólico, existen otros indicadores de enfermedad subclínica que vinculan al SOP con la ECV. Se ha observado que las mujeres con PCOS tienen una mayor incidencia de disfunción diastólica ventricular izquierda y mayor rigidez de las arterias carótidas interna y externa.
ESTERILIDAD
La esterilidad o subfertilidad es una característica frecuente de las mujeres con SOP a causa de los ciclos anovulatorios. Además, en algunas mujeres con esterilidad secundaria a anovulación el SOP es la causa más común y comprende de 80 a 90% de los casos.
ABORTOS
Se sabe que las mujeres embarazadas con SOP tienen una mayor frecuencia (de 30 a 50%) de abortos del primer trimestre que la cifra basal aproximada de 15% en la población general. La causa de esto se desconoce y al principio los estudios retrospectivos y de observación demostraron cierta asociación entre la hipersecreción de LH y los abortos. Sin embargo, en un estudio prospectivo se observó que el hecho de reducir la concentración de LH con agonistas de GnRH no aumenta los beneficios a este respecto.
Otros investigadores sugieren que en estas mujeres la resistencia a la insulina se asocia con los abortos. Con el fin de reducir el índice de abortos, se ha investigado la metformina, fármaco utilizado para reducir la insulina.
CANCER ENDOMETRIAL
Las mujeres con PCOS tienen un riesgo tres veces mayor de padecer cáncer de endometrio. La hiperplasia y el cáncer endometrial son riesgos a largo plazo de la anovulación crónica y se cree que la exposición crónica a los estrógenos sin oposición provoca cambios neoplásicos en el endometrio. Este riesgo aumenta por los efectos del hiperandrogenismo y la hiperinsulemia al reducir la concentración de SHBG y a elevar los estrógenos circulantes.
DIAGNOSTICO
El SOP a menudo se considera un diagnóstico de exclusión. Por consiguiente, es necesario excluir de manera sistemática otros trastornos potencialmente graves con manifestaciones clínicas de SOP.
- HORMONA ESTIMULANTE LA TIROIDES Y PROLACTINA
Las enfermedades de la tiroides frecuentemente provocan disfunción menstrual similar a la que se observa en las mujeres con SOP. Es por esta razón que durante la valoración casi siempre se pide la concentración sérica de TSH.
Asimismo, la hiperprolactinemia es una causa conocida de irregularidades menstruales y amenorrea ocasional. Se cree que la hiperprolactinemia provoca anovulación al inhibir la secreción pulsátil de GnRH del hipotálamo.
- TESTOSTERONA
se puede utilizar la concentración sérica de testosterona para excluir tumores ováricos. La testosterona libre es más sensible que la testosterona total como
indicador de hiperandrogenismo. Sin embargo, si bien están mejorando los análisis actuales de testosterona libre carecen de una referencia uniforme para todos los laboratorios. Por esta razón, el mejor método para excluir la posibilidad de un tumor es cuantificar las concentraciones totales de testosterona. Cuando
la concentración umbral es mayor de 200 ng/100 ml de testosterona total se debe buscar una lesión ovárica.
- SULFATO DE DEHIDROEPIANDROSTERONA
El sulfato de dehidroepiandrosterona es producido casi exclusivamente en la glándula suprarrenal. Por lo tanto, una concentración sérica mayor de 700 μg/100 ml es altamente sugestiva de una neoplasia suprarrenal.
- GONADOTROPINAS
Durante la valoración de la amenorrea, se cuantifica la concentración de FSH y LH para excluir una insuficiencia ovárica precoz e hipogonadismo hipogonadotrópico. Fuera de esto, estos estudios carecen de utilidad adicional para el diagnóstico de SOP. La concentración de LH por lo general es del doble que la de FSH, lo que no se observa en todas las mujeres con PCOS. Específicamente, en 33% de las mujeres con SOP la LH circulante es normal, lo que es más frecuente en las pacientes obesas.
- 17 ALFA - HIDROXIPROGESTERONA
En la hiperplasia suprarrenal congénita (HSC) de inicio tardío, la deficiencia de 21-hidroxilasa, enzima que ocasiona una deficiencia relativa de cortisol. En respuesta, las concentraciones de la hormona adreconorticotrópica (ACTH) están aumentadas para normalizar la producción de cortisol. Como consecuencia de este ajuste, se desarrolla hiperplasia suprarrenal e hiperandrogenismo. Por lo tanto, los síntomas de HSC de inicio tardío reflejan la acumulación de precursores de hormonas esteroideas C19. Estos precursores son biotransformados en dehidroepiandrosterona, androstenediona y testosterona. Por lo tanto, predominan los signos de virilización.
- CÁLCULO DE LA RESISTENCIA A LA INSULINA
Estas pruebas se utilizan a menudo para valorar el metabolismo de la glucosa y la secreción deficiente de insulina en estas mujeres.
Debe tomarse :
1) prueba de tolerancia a la glucosa de 2 h (2-h GTT);2)cuantificación de las concentraciones séricas de insulina en ayuno3) modelo homeostático para la valoración de la resistencia a la insulina .. (HOMA IR)4) medición de la sensibilidad insulínica (QUICKI),5) cálculo del índice sérico glucosa:insulina.
- BIPSIA ENDOMETRIAL
Se recomienda tomar una biopsia endometrial en las mujeres mayores de 35 años de edad con hemorragia anormal y aquellas más jóvenes con hemorragia anovulatoria resistente al tratamiento hormonal.
- ECOGRÁFIA
Desde el punto de vista histológico, el SOP exhibe un mayor volumen, mayor número de folículos maduros y atrésicos, mayor espesor del estroma cortical y mayor número de islotes celulares hiliares.
Muchos de estos cambios se observan en la ecografía y en las mujeres con sospecha de SOP a menudo se realiza ecografía pélvica para valorar los
ovarios. La ecografía tiene especial importancia en las mujeres con SOP en busca de fertilidad y en las mujeres con signos de virilización. La técnica transvaginal de alta definición es superior a la vía transabdominal y tiene un mayor índice de detección de SOP.
Sin embargo, en las adolescentes se prefiere la vía transabdominal. Los criterios ecográficos para diagnosticar SOP según la conferencia de Rótterdam de 2003, comprenden ≥12 quistes pequeños (2 a 9 mm de diámetro) o un incremento del
volumen ovárico (>10 ml) o ambos. Con frecuencia aumenta el estroma en relación con el número de folículos. Basta un solo ovario con estos hallazgos para definir al SOP.
TRATAMIENTO
- PERDIDA DE PESO
La obesidad es prevalente en mujeres con SOP, y se asocia con un empeoramiento de los síntomas. mujeres con un índice de masa corporal (IMC) igual o mayor de 27 kg/m2 son consideradas con obesidad de acuerdo al Consenso Mexicano. La pérdida de peso de un 5-7% con respecto al basal produce un descenso en la concentración circulante de andrógenos, insulina y lípidos, lo cual se acompaña de una mejoría de la sintomatología y de las posibilidades de presentar ciclos ovulatorios. Las dietas altas en proteínas pudieran tener beneficios adicionales en cuanto a los parámetros endocrinos.
- TRATAMIENTO HORMONAL
Los anticonceptivos hormonales combinados proveen varios beneficios en las
pacientes con SOP y durante mucho tiempo han sido la piedra angular del tratamiento. Restituyen los ciclos menstruales con eficiencia y mejoran el hirsutismo en más del 60% de los casos por su efecto inhibidor de la LH, lo que aumenta los niveles de SHBG. También suprimen el metabolismo de los andrógenos en las adrenales y disminuyen el número de receptores de la 5a-reductasa en la piel, lo que beneficia al acné.
El tratamiento debe iniciarse con dosis bajas que se incrementarán de acuerdo a las necesidades. Deben evitarse las formulaciones que contienen norgestrel y
levonorgestrel por su actividad androgénica. En general, las progestinas protegen al endometrio oponiéndose a los efectos proliferativos de los estrógenos pero tienen un efecto negativo en los parámetros metabólicos ya que aumentan la resistencia a la insulina y los niveles de triglicéridos.
- AGENTES SENSIBILIZADORES DE INSULINA
Está documentado que la disminución en los niveles de insulina mediante el uso de este grupo de fármacos se acompaña de una mejoría del cuadro clínico y de las anormalidades metabólicas. Particularmente, en mujeres obesas con SOP han demostrado ser efectivos y pudieran ser considerados dentro de las opciones de elección para el inicio del manejo.
1. METFORMINA
Es un agente anti-hiperglucemiante de la familia de las biguanidas. Actúa principalmente en el hígado inhibiendo parcialmente la gluconeogénesis, lo que reduce en un 17-25% la producción de glucosa y en el músculo esquelético donde incrementa la captación de glucosa estimulada por insulina en un 29% y disminuye la oxidación de los ácidos grasos en un 10-20%.En mujeres con SOP el metformín ha demostrado inducir la ovulación y mejorar las posibilidades de lograr un embarazo, incluso en pacientes sometidas a fertilización in vitro.
La combinación de metformín con anticonceptivos orales o acetato de ciproterona, se ha acompañado de una mejoría en los parámetros clínicos y metabólicos.
2. TIAZOLIDINEDIONAS
Pertenecen a un nuevo grupo de fármacos anti-diabéticos derivados de la ciglitazona, particularmente útiles en estados de resistencia a la insulina por sus efectos en el metabolismo hepático de la glucosa y su acción en tejidos periféricos.
Ejercen sus acciones principalmente en los tejidos periféricos (músculo esquelético) y en segundo término a nivel hepático activando a receptores nucleares específicos de la familia Gama-PPAR (Peroxime proliferator activator receptors), lo que inicia la trancripción genética de proteínas glucotransportadoras (GLUT-1 y GLUT-4), regulando la homeostasia de los lípidos y la diferenciación de los adipocitos, lo que lleva un mejor funcionamiento de la insulina.
- TRATAMIENTO DE LA ANOVULACIÓN
El citrato de clomifeno, solo o en combinación con la pérdida de peso, sigue siendo, dada su seguridad y simplicidad, el tratamiento de primera elección en la infertilidad de origen anovulatorio asociado al SOP.
Actúa predominantemente como un antiestrógeno uniéndose a los receptores hipotalámicos, lo cual disminuye el mecanismo de retroalimentación negativa ejercida por los estrógenos endógenos. Esto aumenta la secreción de GnRH, la que a su vez estimula la secreción de LH y FSH.
El tratamiento con citrato de clomifeno comienza durante la fase proliferativa precoz (del 2do al 5to día del ciclo menstrual) con la administración de 50 mg/
día durante 5 días. Si la anovulación persiste, la dosis puede ser incrementada de 50 en 50 mg al día hasta llegar a una dosis máxima de 250 mg/día y al contrario
que las gonadotrofinas exógenas, el aumento en la dosis de clomifeno no suele asociarse con un aumento del reclutamiento folicular.
La administración de glucocorticoides a bajas dosis puede ser beneficiosa en las mujeres con
anovulación hiperandrogénica. El mecanismo de acción implica la supresión de la síntesis de andrógenos suprarrenales, lo cual provoca una reducción de hasta el 40% del total de andrógenos
circulantes. Igualmente las dosis bajas de glucocorticoides pueden aumentar la síntesis y secreción de FSH. Generalmente se inicia el tratamiento con dexametasona a dosis de 0.25 a 0.5 mg o prednisona 5 mg durante la noche junto con una progestina para inducir la menstruación antes de restituir el citrato de clomifeno.
- TRATAMIENTO DEL HIRSURTISMO
El hirsutismo se presenta en más del 70% de las mujeres con SOP. En una proporción de éstas, se acompaña por otros trastornos de la piel como alopecia, seborrea y acné, siendo todos ellos el resultado de una producción elevada de andrógenos y/o un aumento en la sensibilidad de la piel a los
andrógenos. Hay varios antiandrógenos que reducen el hirsutismo. Los anticonceptivos orales incrementan los niveles de SHBG con un resultante descenso de los niveles de andrógenos libres. También el progestágeno que contienen los hormonales combinados inhibe a la 5a-reductasa en piel lo que mejora el hirsutismo y el acné.
1. ACETATO DE CIPROTERONAEs un derivado de la 17- hidroxiprogesterona que tiene acciones progestágenas, antigonadotrópicas y antiandrogénicas. La mejoría clínica se debe a la inhibición de la testosterona y de la unión de la dihidrotestosterona (DHT) a su receptor intracelular; la concentración reducida de los andrógenos circulantes es el resultado de la inhibición de los andrógenos ováricos a través de la supresión de la liberación de LH.La dosis moderadas (50 mg/día durante 10 días) de acetato de ciproterona acompañadas de un anticonceptivo oral suprimen la LH y testosterona tanto como los análogos de la GnRH. Esta terapia decombinación reduce los niveles plasmáticos de testosterona y androstendiona, suprime las gonadotropinas y aumenta la SHBG. El ACP utilizado como monoterapia a menudo ocasiona amenorrea particularmente en mujeres obesas. Con dosis más elevadas (100 mg/día) se alcanza marcada mejoría, incluso en el hirsutismo severo.2. ESPIRINOLACTONAEs un diurético ahorrador de potasio, antagonista de la aldosterona y con potente acción antiandrogénica. Actúa compitiendo con los receptores androgénicos en su sitio de acción. La dosis recomendada es de 100-200 mg/día dividida en 2 dosis Entre sus efectos adversos destaca la hiperkalemia, por lo que es necesario el monitoreo de los electrolitos séricos con su uso prolongado.3. AGONISTAS DE LA GnRHLos agonistas de la GnRH como el leuprolide, disminuyen la producción ovárica de esteroides por supresión de LH y FSH. Este tratamiento es altamente efectivo en mujeres con SOP severo o hipertecosis ovárica. La supresión de la producción de esteroides ováricos se asocia a sintomatología posmenopáusica como bochornos y resequedad vaginal.
- TRATAMIENTO QUIRÚRGICO
La resección en cuña bilateral de los ovarios es un procedimiento quirúrgico que se realizó con éxito en pacientes con SOP durante muchos años. Esto provoca una reducción en los niveles de LH y producción de andrógenos, sin embargo por las múltiples complicaciones y adherencias relacionadas con el procedimiento ha caído en desuso. Actualmente en casos seleccionados se recurre a la cauterización de los folículos con electrocoagulación.
REFERENCIAS:
- K. Barrera, et al. (2019) Prevalencia de obesidad en mujeres de edad fértil que presentan síndrome de ovario poliquístico.Revista del Centro de Estudio y Desarrollo de la Amazonia , Vol. 09, No. 01, pp. 23–26.
- Williams (2017). Ginecologia de Williams. Capítulo 17. Síndrome de poliquistosis ovárica e hiperandrogenismo.3ra Edición. McGRAW-HILL INTERAMERICANA EDITORES.
- R. Carbajal, C. Herrera, A. Porcile. Espectro fenotípico del síndrome de ovario poliquístico. (2010). REV CHIL OBSTET GINECOL 2010; 75(2): 124 - 132.
- A. Vargas, G. Sanchez, J. Herrera & L. Vargas. (2003). Síndrome de ovario poliquístico: abordaje diagnóstico y terapéutico. Rev Biomed 2003; 14:191-203.







No hay comentarios:
Publicar un comentario